Для ўтварэння малекул хімічныя злучэнні, атамы розных рэчываў або элементаў павінны стабільна спалучацца адзін з адным, і гэта можа адбывацца па-рознаму ў сілу структурных характарыстык, якія мае кожны атам, які, як мы ведаем, складаецца з станоўча зараджанага ядра, акружанага воблакам электронаў.
Электроны зараджаны адмоўна і застаюцца побач з ядром, таму што электрамагнітная сіла прыцягвае іх. Чым бліжэй электрон да ядра, тым большая энергія патрабуецца для яго вызвалення.
Але не ўсе элементы аднолькавыя: некаторыя маюць тэндэнцыю губляць самыя вонкавыя электроны воблака (элементы з нізкай энергіяй іянізацыі), а іншыя, як правіла, захопліваюць іх (элементы з высокім сродствам да электронаў). Гэта адбываецца таму, што згодна з правілам акэта Льюіса, стабільнасць звязана з наяўнасцю 8 электронаў у самай вонкавай абалонцы або арбітале, па меншай меры ў большасці выпадкаў.
Тады як можа быць страта альбо ўзмацненне электронаў, могуць утварацца іёны процілеглага зарада, і электрастатычнае прыцягненне паміж іонамі процілеглага зарада прымушае іх злучыцца і ўтвараць простыя хімічныя злучэнні, у якіх адзін з элементаў аддаваў электроны, а другі атрымліваў іх. Так што гэта можа адбыцца і а іённая сувязь неабходна, каб паміж элементамі, якія ўдзельнічаюць, была розніца ці дэльта электраадмоўнасці не менш за 1,7.
іённая сувязь звычайна ўзнікае паміж металічным злучэннем і неметалічным: атам металу аддае адзін ці некалькі электронаў і, такім чынам, утварае станоўча зараджаныя іёны (катыёны), а неметаль атрымлівае іх і становіцца адмоўна зараджанай часціцай (аніёнам ). Шчолачныя металы і шчолачназямельныя металы - гэта элементы, якія маюць найбольшую тэндэнцыю да ўтварэння катыёнаў, а галогены і кісларод - тыя, якія звычайна складаюць аніёны.
Як звычайна, злучэння, якія ўтвараюцца іённымі сувязямі ёсць цвёрдыя рэчывы пры пакаёвай тэмпературы і высокай тэмпературы плаўлення, растваральныя ў вадзе. У вырашэнні яны вельмі добрыя праваднікі электрычнасцібо яны з'яўляюцца моцнымі электралітамі. Энергія рашоткі іённага цвёрдага цела - гэта тое, што адзначае сілу прыцягнення паміж іёнамі гэтага цвёрдага цела.
Ён можа служыць вам:
- Прыклады кавалентных сувязяў
- Аксід магнію (MgO)
- Сульфат медзі (CuSO4)
- Ёдзісты калій (К.І.)
- Гідраксід цынку (Zn (OH) 2)
- Хлорысты натрый (NaCl)
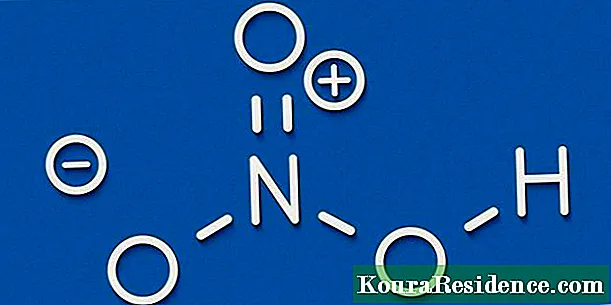
- Нітрат срэбра (AgNO3)
- Фтарыд літыя (LiF)
- Хларыд магнію (MgCl2)
- Гідраксід калія (КОН)
- Нітрат кальцыя (Ca (NO3) 2)
- Фасфат кальцыя (Ca3 (PO4) 2)
- Дыхромат калію (K2Cr2O7)
- Дынатрыю фасфат (Na2HPO4)
- Сульфід жалеза (Fe2S3)
- Браміду калія (KBr)
- Карбанат кальцыя (CaCO3)
- Гіпахларыт натрыю (NaClO)
- Сульфат калію (K2SO4)
- Хларыд марганца (MnCl2)